Необратимая электропорация позволяет эффективно осуществлять абляцию гепатоцеллюлярной карциномы до полного некроза опухоли (Rex G. Cheng)
Journal of vascular and interventional surgery
J Vasc Interv Radiol 2015; 26:1184–1188 http://dx.doi.org/10.1016/j.jvir.2015.05.014
КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ
Рекс Г. Ченг (Rex G. Cheng), доктор медицины; Ренука Бхаттачариа (Renuka Bhattacharya), доктор медицины; Мэтью М. Йех (Matthew M. Yeh), доктор медицины, доктор философии; Сиддхартх А. Падиа (Siddharth A. Padia), доктор медицины
Цель: Полное описание патологических изменений в эксплантатах и их сопоставление с соответствующими рентгенографическими данными у пациентов с гепатоцеллюлярной карциномой (ГЦК), получавших лечение методом необратимой электропорации (НЭП) и с последующей трансплантацией печени.
Материалы и методы: В рамках ретроспективного исследования наблюдались 6 пациентов, которым проводилась НЭП по поводу ГЦК с последующей ортотопической трансплантацией печени в период с 2011 по 2013 г. Из указанных 6 пациентов у 4 имелся цирроз класса А по Чайлд-Пью и у 2 — цирроз класса В. Необратимая электропорация проводилась для одноочаговой ГЦК, медианное значение диаметра опухоли составило 22 мм (диапазон значений: 6–26 мм). В порядке последующего наблюдения через 1 месяц после НЭП, а затем — один раз в 3 месяца вплоть до трансплантации печени выполнялась многофазная визуализация с получением поперечных срезов. Средний временной интервал между НЭП и трансплантацией составил 10 месяцев (диапазон значений: 3–17 мес.). Оценка ответа опухоли на лечение по данным визуализации осуществлялась на основе модифицированных критериев оценки ответа солидных опухолей на терапию (Response Evaluation Criteria In Solid Tumors). Эксплантаты печени исследовались на предмет некроза опухолевой ткани и наличия жизнеспособных раковых клеток в опухолях, подвергавшихся НЭП.
Результаты: По данным визуализации в рамках последующего наблюдения после НЭП для всех опухолей был зафиксирован полный ответ на лечение. Для пяти опухолей зафиксирован полный некроз при отсутствии жизнеспособных раковых клеток, причем область опухоли была четко отграничена от окружающей печеночной паренхимы. Желчные протоки в пределах области терапевтического воздействия были сохранены. У одной опухоли, которая подвергалась НЭП с использованием биполярного зонда, было выявлено o 5% жизнеспособных раковых клеток на периферии.
Выводы: В данном исследовании показана эффективность НЭП в отношении ГЦК по результатам оценки патологических изменений и их сопоставления с рентгенологическими данными.
СОКРАЩЕНИЯ
ГЦК — гепатоцеллюлярная карцинома, НЭП — необратимая электропорация, mRECIST — критерии оценки ответа солидных опухолей на терапию.
Авторы являются сотрудниками медицинских кафедр, отделений гастроэнтерологии (R.G.C., R.B.) и патологии (M.M.Y.), а также подразделения интервенционной радиологии при отделении рентгенологии (S.A.P.) Медицинской школы Вашингтонского университета, Сиэтл, штат Вашингтон. Получено 28 января 2015 г., окончательная редакция получена 6 мая 2015 г., принято 8 мая 2015 г. Корреспонденцию следует направлять S.A.P по адресу: University of Washington Medical Center, 1959 NE Pacific Street, Box 357115, Seattle, WA 98195; E-mail: spadia@uw.edu
S.A.P. является платным консультантом BTG International. Сообщений о конфликте интересов от других авторов не поступало.
Методы чрескожной абляционной терапии играют важную роль в лечении гепатоцеллюлярной карциномы (ГЦК) (1). Методика термической абляции ГЦК эффективна и широко применяется, однако имеет ограничения, связанные с эффектом поглощения тепла и риском термического повреждения прилежащих структур, например кровеносных со-судов, желчных протоков или внутренних органов. Необратимая электропорация (НЭП) — это новая нетермическая методика абляции, предназначенная для лечения новообразований мягких тканей, в том числе ГЦК (2). НЭП предполагает использование слабого тока высокого напряжения с целью необратимого увеличения проницаемости мембран клеток-мишеней, нарушения клеточного гомеостаза и индукции апоптоза (3).
Доказано, что НЭП позволяет эффективно осуществлять абляцию ткани в областях печени, представляющих риск. У модельных свиней в результате НЭП формируются большие сливающиеся области полной гибели клеток,— при этом, как показывают макроскопические и гистологические исследования, сохраняются кровеносные сосуды и желчные протоки (4). НЭП также индуцирует полную гибель клеток вплоть до границ крупных сосудов в области ворот печени, причем удается избежать эффекта поглощения тепла, который имеет место при термической абляции (5). Благодаря этим особенностям НЭП потенциально обладает преимуществом перед радиочастотной (РЧ) абляцией при лечении злокачественных новообразований печени в зонах, представляющих высокий риск.
Безопасность применения НЭП в отношении злокачественных опухолей печени оценивалась во многих клинических исследованиях (2,6–10). Ряд исследований показал эффективность этой методики при лечении небольших ГЦК (по рентгенографическим данным о локальном ответе опухолей на терапию, полученным в рамках последующего наблюдения) (8,11). Однако эффективность НЭП у человека не оценивалась с точки зрения корреляции с патологическими аспектами. Цель данного исследования состояла в изучении патологических изменений в эксплантатах у шести пациентов с циррозом, которым проводилась НЭП по поводу нерезектабельных ГЦК и в конечном итоге была выполнена пересадка печени. Эксплантаты оценивались на предмет гибели клеток ГЦК, и результаты этой оценки сопоставлялись с последними данными визуализации, полученными до трансплантации.
МАТЕРИАЛЫ И МЕТОДЫ
Ретроспективное исследование проводилось в одном медицинском учреждении и предполагало запрос данных о пациентах из информационной системы учреждения с целью выявления всех пациентов, которым проводилась НЭП и которые в дальнейшем наблюдались по поводу ГЦК в период с апреля 2011 г. по декабрь 2013 г. Полученная информация была сведена в базу данных в соответствии с требованиями Закона о преемственности и подотчетности медицинского страхования (Health Insurance Portability and Accountability Act) и утверждена экспертным советом медицинского учреждения с выдачей разрешения на отступление от требования получения информированного согласия. Из 38 пациентов, которым в течение указанного периода времени проводилась НЭП по поводу злокачественных новообразований печени, было отобрано шесть пациентов, получавших лечение ГЦК посредством НЭП с последующей трансплантацией печени.
Критерии включения в исследование
Случаи всех пациентов с диагнозом «ГЦК» были рассмотрены междисциплинарной комиссией по опухолям печени медицинского учреждения. Пациенты рассматривались в качестве кандидатов на НЭП при условии соответствия следующим критериям: (a) индексная опухоль имела размер ≤ 3 см по наибольшему измерению; (b) опухоли не подлежали РЧ-абляции из-за близости расположения желчных протоков, внутренних органов, не допускающих мобилизации, или крупных сосудов (диаметром > 3 мм), потенциально способных поглощать тепло при абляции; (c) опухоль была технически доступна для НЭП; (d) «радикальное лечение» (например, немедленная трансплантация печени, хирургическая резекция) не рассматривалось в качестве возможного варианта помощи больному; (e) тяжесть цирроза соответствовала классу A или B по Чайлд-Тюркотт-Пью; (f) отсутствовал тромбоз воротной вены; (g) отсутствовала внепеченочная патология; (h) статус общего состояния соответствовал значениям 0–2 по шкале Восточной кооперативной онкологической группы (ECOG).
Демографические данные пациента
В период времени, рассматриваемый в рамках исследования, пяти мужчинам и одной женщине проводилась НЭП по поводу ГЦК, а в дальнейшем — трансплантация печени (таблица). На момент проведения НЭП средний возраст пациентов составлял 61 год (диапазон значений: 56– 65 лет). У пяти пациентов имелся цирроз, связанный с гепатитом С, у одного пациента имелся цирроз, обусловленный вторичной перегрузкой железом. Диагноз «ГЦК» был рентгенографически подтвержден у четырех пациентов; двум пациентам для подтверждения диагноза в соответствии с критериями Американской ассоциации по изучению заболеваний печени (American Association for the Study of Liver Diseases) потребовалась биопсия (12). У четырех пациентов тяжесть цирроза соответствовала классу А по Чайлд-Тюркотт-Пью, у двоих — классу В. Статус общего состояния всех пациентов соответствовал значениям 0–1 по шкале Восточной кооперативной онкологической группы (ECOG). Среднее значение показателя MELD (Модель для терминальной стадии заболевания печени) составляло 10 (Таблица). У трех пациентов имелся многоочаговый рак, соответствующий Миланским критериям; остальные опухоли подвергались трансартериальной химиоэмболизации либо РЧ-абляции или обеим этим процедурам.
Таблица. Демографические данные пациента, характеристики опухоли и исходы лечения
| Пациент | MELD/CTP | Размер опухоли (мм) | Сегмент по Куино | Предшествующее лечение | Прилежащие структуры | Электроды | mRECIST | Время до трансплантации (мес.) |
|---|---|---|---|---|---|---|---|---|
| 1 | 6/A | 19 | III | Нет | Толстая кишка | 4 | ПО | 12 |
| 2 | 16/B | 25 | VIII | Нет | Печеночная вена, воротная вена | 4 | ПО | 17 |
| 3 | 7/A | 6 | III | Трансартериальная химиоэмболизация / РЧ-абляция | Желудок | 1 | ПО | 11 |
| 4 | 11/B | 24 | V | Трансартериальная химиоэмболизация x 2 | Желчный пузырь и желчные протоки, воротная вена, печеночная артерия | 4 | ПО | 3 |
| 5 | 6/A | 10 | II/IVa | Нет | Воротная вена | 3 | ПО | 6 |
| 6 | 12/A | 26 | V | Трансартериальная химиоэмболизация | Воротная вена | 4 | ПО | 11 |
ПО = полный ответ
CTP = Чайлд-Тюркотт-Пью
MELD = модель для терминальной стадии заболевания печени
mRECIST = модифицированные критерии оценки ответа солидных опухолей на терапию
РЧ = радиочастотная
Характеристики опухолей
У каждого пациента НЭП проводилась для одной опухоли (таблица). Для трех опухолей лечение ранее не проводилось, эти опухоли имели размеры 10–25 мм по длинной оси. В трех из опухолей, ранее подвергавшихся лечению, при визуализации с интервалом перед НЭП были выявлены остаточные очаги ГЦК (контрастируемые в артериальной фазе с вымыванием контраста в отсроченную фазу). Две из этих опухолей ранее подвергались трансартериальной химиоэмболизации, причем при последующей визуализации ответ на это лечение не был зафиксирован. Последняя опухоль (размером 34 мм) ранее подвергалась химиоэмболизации в сочетании с чрескожной РЧ-абляцией. Для этой опухоли был зафиксирован остаточный очаг ГЦК размером 6 мм, определяемый на изображениях сегмента III в медиальной проекции и расположенный в непосредственной близости от желудка. Ни одна из шести опухолей не подлежала РЧ-абляции, поскольку опухоли располагались вблизи крупных сосудов (диаметром 4 3 мм), магистральных желчных протоков или внутренних органов (желудка, толстой кишки).
Протокол НЭП
НЭП выполнялась одним интервенционным радиологом (S.A.P.). Процедуры проводились под общей анестезией с полным обездвиживанием, обеспечиваемым фармакологической нервно-мышечной блокадой. На опухоль-мишень с разных сторон накладывалось от трех до четырех монополярных электродов 19 калибра (NanoKnife; AngioDynamics, Queensbury, New York), вводимых чрескожно. Количество электродов выбиралось в соответствии с размером и морфологией опухоли (для более крупных опухолей требовалось больше электродов). В зависимости от размера опухоли определялась надлежащая граница абляции, расчетная ширина края абляции составляла 5 мм. Электроды располагались параллельно, глубина воздействия электрода в дистальном направлении составляла 15–20 мм. Процедуры выполнялись под контролем компьютерной томографии (КТ) (или КТ с коническим пучком с использованием С-дуги) и ультразвуковой визуализации (рис. 1a–c). В одном случае использовался один биполярный электрод для воздействия на очаг малого размера (6 мм) остаточной накапливающей контраст опухоли после химиоэмболизации в сочетании с РЧ-абляцией. Эта остаточная накапливающая контраст опухоль располагалась в непосредственной близости от желудка, и, по мнению врача, параллельное наложение двух монополярных электродов было технически невозможным. Биполярный электрод предназначался для коррекции края или воздействия на очень небольшие участки опухоли: размер зоны абляции такого электрода составлял 5 мм. В последствии производство биполярных электродов было прекращено.
В ходе процедуры НЭП между электродами каждой пары генерировались в общей сложности 90 коротких (90–100 мкс) электрических импульсов (1500 В/см между двумя электродами, не менее 2250 В для электродов, расположенных на расстоянии 15 мм друг от друга). В рамках каждого сеанса лечения абляция производилась в два этапа. На втором этапе ток подавался между электродами каждой пары в обратном направлении. После процедуры НЭП электроды удалялись. В целях обеспечения надлежащей подачи энергии оценивалась соответствующая кривая, последовательно показывающая увеличение подаваемого тока в течение каждого временного интервала воздействия. В порядке последующего наблюдения через 1 месяц после НЭП, а затем — один раз в 3 месяца вплоть до трансплантации печени выполнялась визуализация. Оценка эффективности методики и поиск остаточных опухолевых очагов, не устраненных при абляции, осуществлялись путем выявления контрастируемых остатков опухоли при визуализации в рамках последующего наблюдения за пациентами (13).
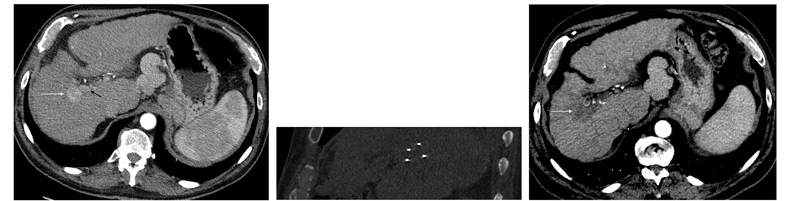
Рисунок 1. (a) На КТ-изображении с контрастированием, полученном у 63-летнего мужчины с хроническим гепатитом C, видна ГЦК размером 2,5 см (указана белой стрелкой) в сегменте VIII. Опухоль располагалась в непосредственной близости от правой ветви воротной вены (указана черной стрелкой) и средней печеночной вены. (b) На КТ-изображении в косой фронтальной проекции видны четыре чрескожных электрода НЭП, параллельно движущиеся к области опухоли. (c) На КТ-изображении с контрастированием, полученном в рамках последующего наблюдения через 3 месяца после НЭП, виден полный некроз опухоли (указано стрелкой) без контрастируемых остаточных очагов. Проходимость прилежащих сосудов сохранена.
Оценка патологических изменений
Патологические характеристики опухоли исследовались и оценивались опытным специалистом по патологии печени (M.M.Y.). Из эксплантатов печени получали последовательные срезы, которые исследовались по стандартному протоколу (с интервалом 5 мм, сверху вниз). Все опухолевые узлы исследовались макроскопически, и все макроскопически жизнеспособные опухоли отправлялись на гистологическое исследование. Репрезентативные блоки из каждой опухоли фиксировались в 10%-ном формалине и заливались в парафиновые блоки. На предметных стеклах получали препараты окрашенных гематоксилином и эозином срезов толщиной 5-мкм из каждого блока. Препараты на стеклах исследовались на предмет наличия жизнеспособной ткани карциномы и неопухолевой паренхимы. Степень некроза или наличие жизнеспособной опухолевой ткани оценивались посредством макроскопического и микроскопического исследования.
Результаты
Лечение и рентгенографическая оценка
Для каждой опухоли-мишени выполнялось по одной процедуре НЭП (таблица). Четырем пациентам лечение проводилось с использованием четырехэлектродной системы, одному пациенту — с использованием системы из трех электродов, и у одного пациента использовался лишь один биполярный электрод. Пациенту, которому ранее выполнялась РЧ-абляция, проводили лечение с применением одного биполярного электрода (их выпуск впоследствии был прекращен производителем) с воздействием на контрастируемый в артериальной фазе остаточный очаг размером 6 мм, расположенный на периферии опухоли размером 34 мм. По всем данным визуализации в рамках последующего наблюдения для всех опухолей, подвергавшихся НЭП, был зафиксирован полный ответ на лечение (т. е. отсутствие контрастируемых остатков опухолевой ткани). Согласно результатам визуализации, ни одна опухоль не требовала дополнительной локорегионарной терапии в период между проведением НЭП и трансплантацией.
Результаты патологических исследований
Всем пациентам была выполнена трансплантация печени в среднем через 10 месяцев после НЭП (диапазон значений: 3–17 мес.) (таблица). Во всех шести эксплантатах печени опухоль не выходила за пределы печени, сосудистая инвазия отсутствовала. Для пяти опухолей с макроскопическим размером от 12 до 30 мм была зафиксирована полная гибель клеток при отсутствии жизнеспособных раковых клеток. Гистологически во всех зонах терапевтического воздействия фиксировались сливащиеся области некроза, четко ограниченные окружающей стромой, с неповрежденными портальными трактами и цирротическими узлами (рис. 2a–c). При большем увеличении обнаруживались нежизнеспособные ткани ГЦК с нечеткими контурами клеток и ядер и сгустками цитоплазмы. В ГЦК, подвергнутой НЭП с использованием одного биполярного электрода (а до этого — РЧ-абляции) и имевшей макроскопический размер 3,5 см, было обнаружено o 5% жизнеспособных раковых клеток на периферии. В пределах области некроза проходил один желчный проток, сохранность которого не была нарушена.
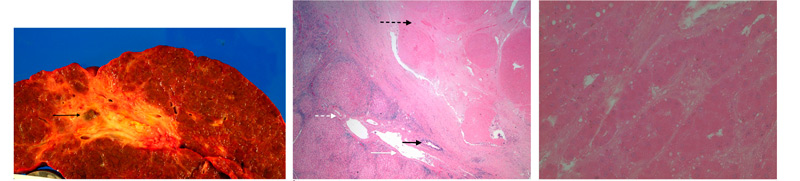
Рисунок 2. (a) На эксплантате пораженной циррозом печени виден узел размером 1,2 см x 1,0 см зеленовато-коричневого цвета с очагами размягчения и некроза (указан стрелкой). (b) На микрофотоснимке виден полностью некротизированный узел ГЦК справа (указан пунктирной черной стрелкой). Прилежащий желчный проток (указан сплошной черной стрелкой), воротная вена (указана сплошной белой стрелкой) и печеночная артерия (указана пунктирной белой стрелкой) сохранны (препарат окрашен гематоксилином и эозином, 20-кратное увеличение). (c) На микроснимке представлена нежизнеспособная ГЦК с «тенями клеток», сгустками цитоплазмы, нечетким клеточным контуром и очертаниями ядер (препарат окрашен гематоксилином и эозином, 100-кратное увеличение).
Обсуждение
До настоящего времени патологические исходы НЭП описывались только для печени здоровых свиней. Ли и др. (Lee et al) (4) показали, что при макроскопическом и гистологическом исследовании через 14 дней после НЭП определялись четко ограниченные области полной гибели клеток. При окрашивании образцов гематоксилином и эозином обнаруживалось полнокровие сосудов и геморрагический некроз. При специальном окрашивании выявлялся выход во внеклеточное пространство кальция и апоптотических телец, что подтверждало индуцированную НЭП клеточную гибель посредством апоптоза. Кроме того, выяснилось, что кровеносные сосуды и желчные протоки остаются сохранными. Согласно выдвигаемой гипотезе, защита этих структур обеспечивается, в частности, более высокой плотностью коллагеновой соединительной ткани или наличием щелевых соединений, где электрические импульсы рассеиваются (4). Карпентье и др. (Charpentier et al) (5) продемонстрировали аналогичные результаты для воротной области печени свиней, свидетельствующие об отсутствии влияния эффекта поглощения тепла на абляцию патологической ткани.
В предшествующей литературе сообщалось о безопасности проведения НЭП у человека (10). Томсон и др. (Thomson et al) (2) изучали результаты НЭП в исследовании с участием 10 пациентов с 17 ГЦК. Кингэм и др. (Kingham et al) (6) исследовали безопасность воздействия НЭП на печеночные вены и портальную ножку при лечении злокачественных новообразований печени. В работе Силк и др. (Silk et al) (7) определялась безопасность лечения злокачественных поражений печени центральной локализации, расположенных вблизи магистрального желчного протока. В этой серии исследований нежелательные явления не наблюдались. Безопасность процедур НЭП, рассмотренных в этих исследованиях, свидетельствует о сохранении после НЭП таких центральных структур, как желчные протоки, печеночные артерии и воротные вены. В нашем исследовании выявлена сохранность этих структур в эксплантатах печени.
Клинические исследования с использованием рентгенологического контроля ответа на лечение показали, что НЭП позволяет эффективно лечить нерезектабельные ГЦК небольшого размера. В работе Кэннон и др. (Cannon et al) (11) продемонстрирована 98% локальная выживаемость при отсутствии рецидивов через 12 месяцев у пациентов со злокачественными новообразованиями печени размером r 3 см, получавших лечение посредством НЭП. Чеунг и др. (Cheung et al) (8) показали аналогичные результаты НЭП для 18 нерезактабельных ГЦК: в среднем через 14 месяцев последующего наблюдения в отношении 93% опухолей размером r 3 см не отмечалось локальных рецидивов, а доля опухолей размером 4 3 см составила 0%. Наши данные, а именно результаты патологических исследований подтверждают эффективность НЭП. Для всех пяти опухолей-мишеней размером 3 см фиксировалась полная гибель клеток при отсутствии жизнеспособных остатков карциномы в среднем на протяжении 10 месяцев (по истечении этого периода времени пациентам выполнялась трансплантация). Отсутствие рецидивов патологии в течение этого временного промежутка подтверждает эффективность данной методики.
Для одной из опухолей, подвергавшихся терапевтическому воздействию ранее, были обнаружено минимальное количество жизнеспособной раковой ткани через 11 месяцев после НЭП. Это, вероятно, объясняется тем, что обеспечиваемая одним биполярным электродом небольшая зона абляции не позволила полностью охватить область остаточной опухоли. После проведения этой процедуры биполярный электрод для НЭП был снят с продажи производителем, который сослался на технические проблемы, связанные с проводимостью. Возможно, параметры лечения при работе с биполярным электродом значительно отличаются от таковых для стандартных монополярных, так что при использовании одних и тех же параметров на опухоль в данном случае не было оказано надлежащего воздействия.
Патологические исходы других видов локорегионарной терапии, таких как РЧ-абляция и трансартериальная химиоэмболизация, играют важную роль в прогнозировании рецидивов ГЦК после трансплантации печени. Корнберг и др. (Kornberg et al) (14) показали, что для ГЦК с 4 50% некрозом патологической ткани после локорегионарной терапии можно прогнозировать 96% выживаемость без рецидивов через 5 лет после трансплантации печени, тогда как при некрозе опухоли o 50% выживаемость составляет лишь 55%. Монталти и др. (Montalti et al) (15) продемонстрировали, что отсутствие жизнеспособной ткани карциномы в эксплантатах позволяет прогнозировать 100% выживаемость без рецидивов через 5 лет после трансплантации, в то время как при наличии жизнеспособных раковых клеток в эксплантатах показатель выживаемости составляет 81%. Наш предварительный опыт свидетельствует о том, что лечение ГЦК методом НЭП позволяет достигать высоких показателей гибели клеток, в частности полного некроза патологической ткани в пяти из шести случаев. Вероятно, метод НЭП целесообразно применять для абляции опухолей перед трансплантацией с целью предотвращения рецидивов ГЦК.
Точное стадирование ГЦК по рентгенографическим данным имеет ключевое значение для оценки ответа опухоли на локорегионарную терапию. Разработана более надежная система мониторинга состояния ГЦК после лечения по контрастируемой остаточной опухолевой ткани , которая дает возможность оценить жизнеспособность опухоли не по ее размеру, а по поглощению ею контрастного вещества в артериальной фазе контрастирования (16). Результаты проведенного позднее валидационного исследования показали, что модифицированные критерии оценки ответа солидных опухолей на терапию (Response Evaluation Criteria In Solid Tumors, mRECIST) позволяют достоверно выявлять опухоли, поддающиеся лечению посредством химиоэмболизации, используя данные исследования эксплантатов для установления корреляции с патологическими показателями (17); эти результаты даже были учтены при составлении недавно опубликованных стандартов отчетности по процедурам абляции (13). Данная серия исследований свидетельствует о соответствии данных рентгенологических и патологических исследований при использовании mRECIST для интерпретации ответа на НЭП. Для подтверждения этой гипотезы требуются более масштабные исследования.
Проведенное исследование имеет некоторые ограничения. Во-первых, выводы, сделанные на основании результатов исследования столь небольшой выборки, нуждаются в дальнейшем подтверждении касательно эффективности НЭП и оптимальных параметров лечения за счет использования более обширных популяций пациентов. Во-вторых, представленные здесь результаты получены для цирроза печени и ГЦК и не обязательно распространяются на метастатические опухоли печени, в отношении которых могут быть неприменимы критерии mRECIST; кроме того, проводящие свойства ткани печени, не пораженной циррозом, могут быть иными. В-третьих, хотя три опухоли, не подвергавшиеся терапевтическому воздействию ранее, удалось эффективно обработать методом НЭП до полной гибели клеток, тот факт, что остальные опухоли в прошлом подвергались лечению, возможно, подрывает состоятельность нашей интерпретации эффективности исследуемого метода. Наконец, хотя гибель клеток была зафиксирована по данным визуализации у всех пациентов, поскольку эксплантаты были получены не ранее чем через три месяца после лечения, задержка по времени и развитие сливающегося некроза не позволили выполнить специальное окрашивание, для того чтобы точно установить, что механизмом гибели клеток являлся именно апоптоз, индуцированный НЭП.
В заключение следует сказать, что результаты этой серии исследований подтверждают достижение гибели клеток и коррелируют с данными визуализации с получением поперечных срезов у пациентов, которым проводилась процедура НЭП. Кроме того, необходимо отметить, что в зоне терапевтического воздействия удается сохранить кровеносные сосуды и желчные протоки. Для адекватного выбора НЭП в качестве метода лечения ГЦК требуются дальнейшие исследования.
Литература References
Lencioni, R. Loco-regional treatment of hepatocellular carcinoma. Hepatology. 2010;52:762–773.
Thomson, K.R., Cheung, W., Ellis, S.J. et al, Investigation of the safety of irreversible electroporation in humans. J Vasc Interv Radiol. 2011;22:611–621.
Davalos, R.V., Mir, I.L., Rubinsky, B. Tissue ablation with irreversible electroporation. Ann Biomed Eng. 2005;33:223–231.
Lee, E.W., Chen, C., Prieto, V.E., Dry, S.M., Loh, C.T., Kee, S.T. Advanced hepatic ablation technique for creating complete cell death: irreversible electroporation. Radiology. 2010;255:426–433.
Charpentier, K.P., Wolf, F., Noble, L., Winn, B., Resnick, M., Dupuy, D.E. Irreversible electroporation of the liver and liver hilum in swine. HPB (Oxford). 2011;13:168–173.
Kingham, T.P., Karkar, A.M., DʼAngelica, M.I. et al, Ablation of perivascular hepatic malignant tumors with irreversible electroporation. J Am Coll Surg. 2012;215:379–387.
Silk, M.T., Wimmer, T., Lee, K.S. et al, Percutaneous ablation of peribiliary tumors with irreversible electroporation. J Vasc Interv Radiol. 2014;25:112–118.
Cheung, W., Kavnoudias, H., Roberts, S., Szkandera, B., Kemp, W., Thomson, K.R. Irreversible electroporation for unresectable hepatocellular carcinoma: initial experience and review of safety and outcomes. Technol Cancer Res Treat. 2013;12:233–241.
Narayanan, G., Froud, T., Suthar, R., Barbery, K. Irreversible electroporation of hepatic malignancy. Semin Intervent Radiol. 2013;30:67–73.
Scheffer, H.J., Nielsen, K., de Jong, M.C. et al, Irreversible electroporation for nonthermal tumor ablation in the clinical setting: a systematic review of safety and efficacy. J Vasc Interv Radiol. 2014;25:997–1011 (quiz 1011).
Cannon, R., Ellis, S., Hayes, D., Narayanan, G., Martin, R.C. Safety and early efficacy of irreversible electroporation for hepatic tumors in proximity to vital structures. J Surg Oncol. 2013;107:544–549.
Bruix, J., Sherman, M. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020–1022.
Ahmed, M., Solbiati, L., Brace, C.L. et al, Image-guided tumor ablation: standardization of terminology and reporting criteria—a 10-year update. J Vasc Interv Radiol. 2014;25:1691–1705.
Kornberg, A., Witt, U., Kupper, B., Wildgruber, M., Friess, H. Postinterventional tumor necrosis predicts recurrence-free long-term survival in liver transplant patients with advanced hepatocellular carcinoma. Transplant Proc. 2013;45:1913–1915.
Montalti, R., Mimmo, A., Rompianesi, G. et al, Absence of viable HCC in the native liver is an independent protective factor of tumor recurrence after liver transplantation. Transplantation. 2014;97:220–226.
Lencioni, R., Llovet, J.M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010;30:52–60.
Bargellini, I., Bozzi, E., Campani, D. et al, Modified RECIST to assess tumor response after transarterial chemoembolization of hepatocellular carcinoma: CT-pathologic correlation in 178 liver explants. Eur J Radiol. 2013;82:e212–e218.